Существуют разные системы классификации органических реакций, которые основаны на различных признаках. Среди них можно выделить классификации:
- по конечному результату реакции, то есть изменению в структуре субстрата-
- помеханизму протекания реакции, то есть по типу разрыва связей и типу реагентов.
Взаимодействующие в органической реакции вещества подразделяют на реагент и субстрат. При этом считается, что реагент атакует субстрат.
ОПРЕДЕЛЕНИЕ
Реагент - вещество, действующее на объект - субстрат - и вызывающее в нем изменение химической связи. Реагенты делятся на радикальные, электрофильные и нуклеофильные.
ОПРЕДЕЛЕНИЕ
Субстратом, как правило, считают молекулу, которая предоставляет атом углерода для новой связи.
КЛАССИФИКАЦИЯ РЕАКЦИЙ ПО КОНЕЧНОМУ РЕЗУЛЬТАТУ (ИЗМЕНЕНИЮ В СТРУКТУРЕ СУБСТРАТА)
В органической химии различают четыре вида реакций по конечному результату и изменению в структуре субстрата: присоединения, замещения, отщепления,или элиминирования (от англ. to eliminate - удалять, отщеплять), и перегруппировки (изомеризации). Такая классификация аналогична классификации реакций в неорганической химии по числу исходных реагентов и образующихся веществ, с изменением или без изменения состава. Классификация по конечному результату основана на формальных признаках, так как стехиометрическое уравнение, как правило, не отражает механизм реакции. Сравним типы реакций в неорганической и органической химии.
| Тип реакции в неорганической химии | Пример | Тип реакции в органической химии |
Разновидность
и пример Реакции |
|---|---|---|---|
| 1. Соединение | Cl2+H2=2HCl | Присоединение по кратным связям | Гидрирование |
|
Гидрогалогенирование
|
|||
|
Галогенирование
|
|||
|
Гидратация
|
|||
| 2. Разложение | 2H2O=2H2+O2 | Элиминирование |
Дегидрирование
|
|
Дегидрогалогенирование
|
|||
|
Дегалогенирование
|
|||
|
Дегидратация
|
|||
| 3. Замещение | Zn+2HCl=ZnCl2+H2 | Замещение |
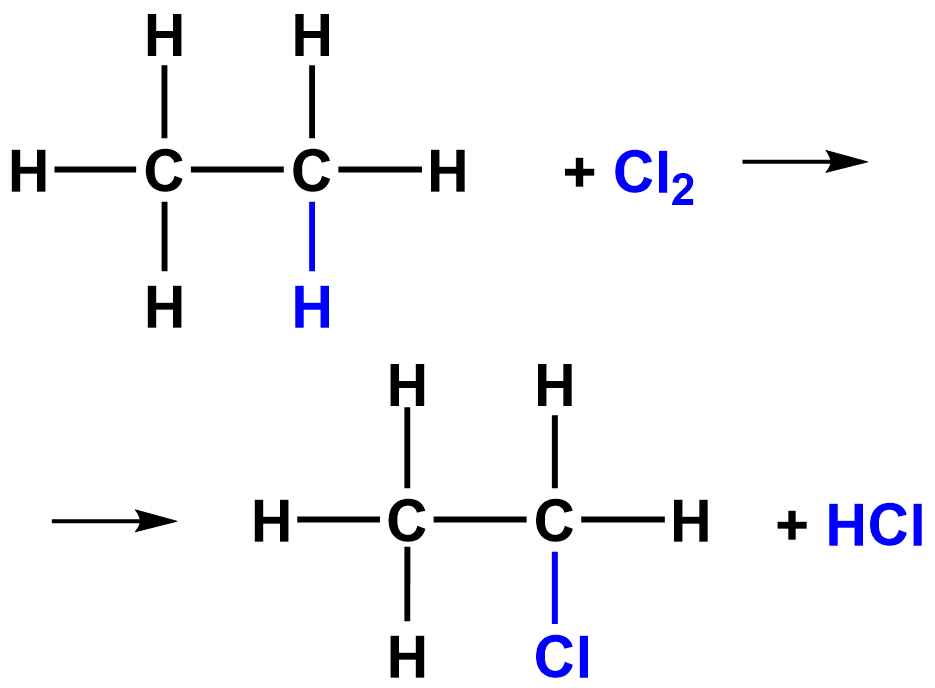
|
| 4. Обмен (частный случай - нейтрализация) | H2SO4+2NaOH=Na2SO4+2H2O | частный случай - этерификация |
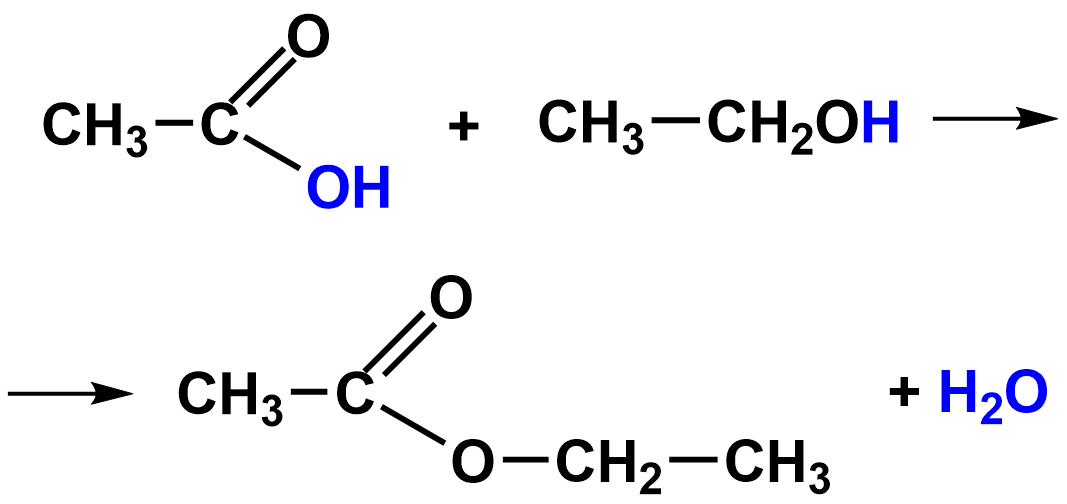
|
| 5.Аллотропизация |
графит⇔ алмаз
Pкрасн.⇔P бел.Pкрасн.⇔P бел. Sромб.⇔Sпласт.Sромб.⇔Sпласт. |
Изомеризация |
Изомеризация
алканов |
п) без замены их другими.
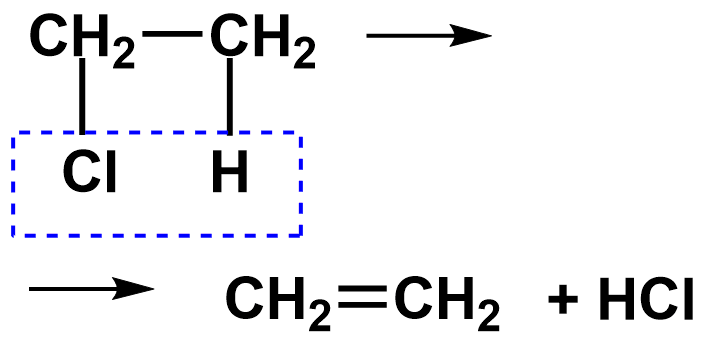
В зависимости от того, какие атомы отщепляются - соседние C–C или изолированные двумя-тремя или более атомами углерода –C–C–C–C–, –C–C–C–C–C–, могут образовываться соединения с кратными связями или циклические соединения. Отщепление галогеноводородов из алкилгалогенидов либо воды из спиртов происходит по правилу Зайцева.
ОПРЕДЕЛЕНИЕ
Правило Зайцева: атом водорода Н отщепляется от наименее гидрогенизированного атома углерода.
Например, отщепление молекулы бромоводорода происходит от соседних атомов в присутствии щелочи, при этом образуется бромид натрия и вода.
ОПРЕДЕЛЕНИЕ
Перегруппировка - химическая реакция, в результате которой происходит изменение взаимного расположения атомов в молекуле, перемещение кратных связей или изменение их кратности.
Перегруппировка может осуществляться с сохранением атомного состава молекулы (изомеризация) или с его изменением.
ОПРЕДЕЛЕНИЕ
Изомеризация - частный случай реакции перегруппировки, приводящая к превращению химического соединения в изомер путем структурного изменения углеродного скелета.
Перегруппировка тоже может осуществляться по гомолитическому или гетеролитическому механизму. Молекулярные перегруппировки могут классифицироваться по разным признакам, например по насыщенности систем, по природе мигрирующей группы, по стереоспецифичности и др. Многие реакции перегруппировки имеют специфические названия - перегруппировка Кляйзена, перегруппировка Бекмана и др.
Реакции изомеризации широко используются в промышленных процессах, например при переработке нефти для повышения октанового числа бензина. Примером изомеризации является превращение н-октана в изооктан:
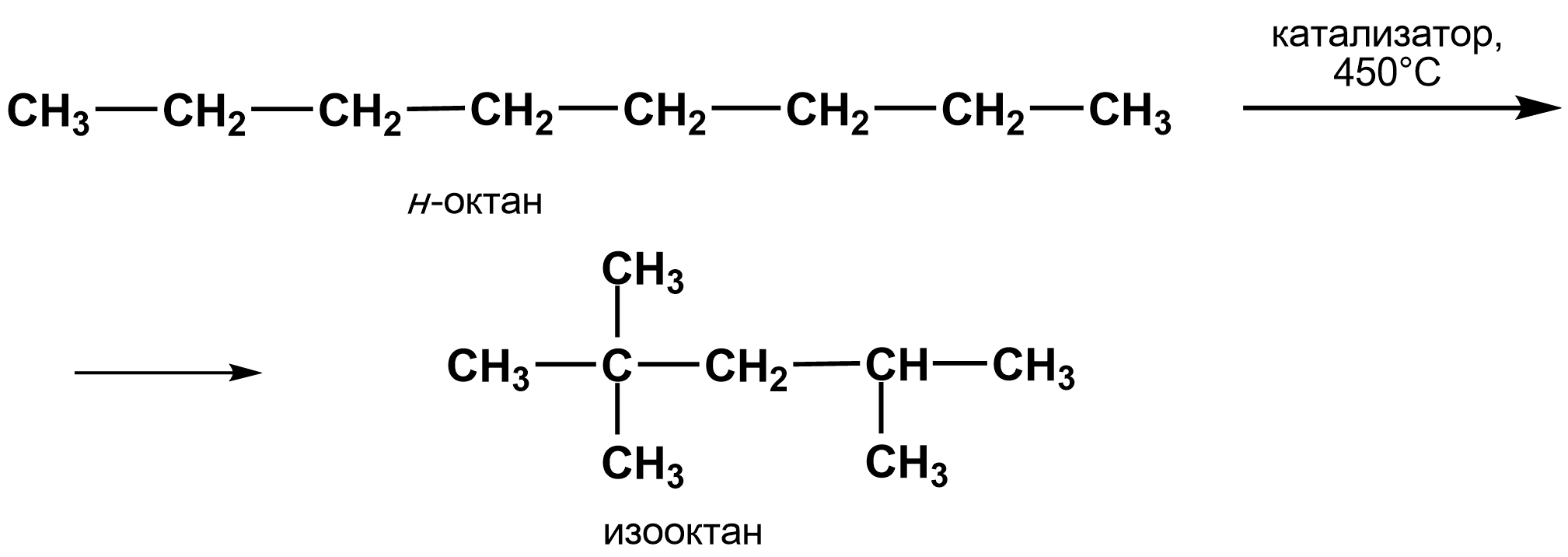
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ ПО ТИПУ РЕАГЕНТА
РАЗРЫВ СВЯЗИ
Разрыв связи в органических соединениях может гомолитическим и гетеролитическим.
ОПРЕДЕЛЕНИЕ
Гомолитический разрыв связи - это такой разрыв, в результате которого каждый атом получает неспаренный электрон и образуются две частицы, имеющие сходное электронное строение - свободные радикалы.
Гомолитический разрыв характерен для неполярных или слабополярных связей, например C–C, Cl–Cl, C–H, и требует большого количества энергии.
Образующиеся радикалы, имеющие неспаренный электрон, обладают высокой реакционной способностью, поэтому химические процессы, протекающие с участием таких частиц, часто носят «цепной» характер, их трудно контролировать, а в результате реакции получается набор продуктов замещения. Так, при хлорировании метана продуктами замещения являются хлорметан CH3ClCH3Cl, дихлорметан CH2Cl2CH2Cl2, хлороформ CHCl3CHCl3 и четыреххлористый углерод CCl4CCl4. Реакции с участием свободных радикалов протекают по обменному механизму образования химических связей.
Образующиеся в ходе такого разрыва связи радикалы обуславливают радикальный механизм протекания реакции. Радикальные реакции обычно протекают при повышенных температурах или при излучении (например, свет).
В силу своей высокой реакционной способности свободные радикалы могут оказывать негативное воздействие на организм человека, разрушая клеточные мембраны, воздействуя на ДНК и вызывая преждевременное старение. Эти процессы связаны, в первую очередь, с пероксидным окислением липидов, то есть разрушением структуры полиненасыщенных кислот, образующих жир внутри клеточной мембраны.
ОПРЕДЕЛЕНИЕ
Гетеролитический разрыв связи - это такой разрыв, при котором электронная пара остается у более электроотрицательного атома и образуются две заряженные частицы - ионы: катион (положительный) и анион (отрицательный).
В химических реакциях эти частицы выполняют функции «нуклеофилов» («фил» - от гр. любить) и «электрофилов», образуя химическую связь с партнером по реакции по донорно-акцепторному механизму. Частицы-нуклеофилы предоставляют электронную пару для образования новой связи. Другими словами,
ОПРЕДЕЛЕНИЕ
Нуклеофил - электроноизбыточный химический реагент, способный взаимодействовать с электронодефицитными соединениями.
Примерами нуклеофилов являются любые анионы (Cl−,I−,NO−3Cl−,I−,NO3− и др.), а также соединения, имеющие неподеленную электронную пару (NH3,H2ONH3,H2O).
Таким образом, при разрыве связи могут образоваться радикалы или нуклеофилы и электрофилы. Исходя из этого выделяют три механизма протекания органических реакций.
МЕХАНИЗМЫ ПРОТЕКАНИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
Свободно-радикальный механизм: реакцию начинают свободные радикалы, образующиеся при гомолитическом разрыве связи в молекуле.
Наиболее типичный вариант - образование радикалов хлора или брома при УФ-облучении.
1. Свободно-радикальное замещение
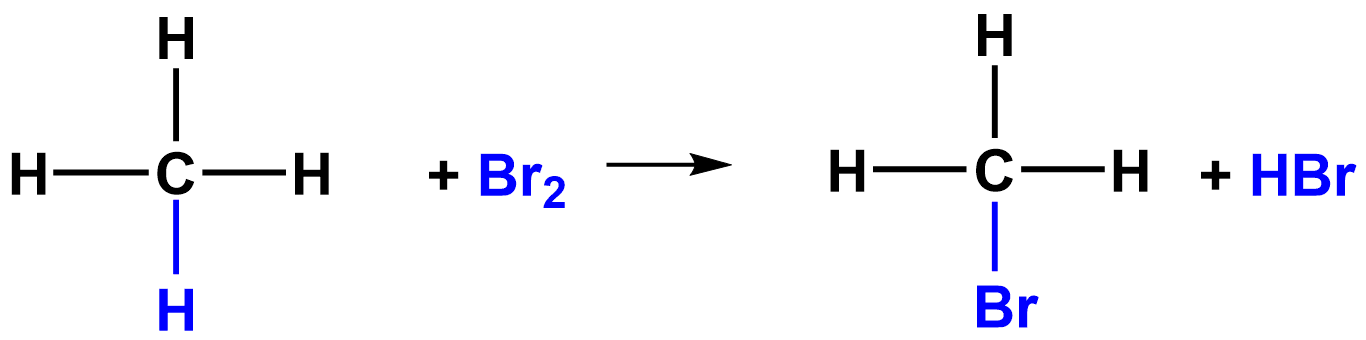
метан бромметан
Инициирование цепи

Рост цепи
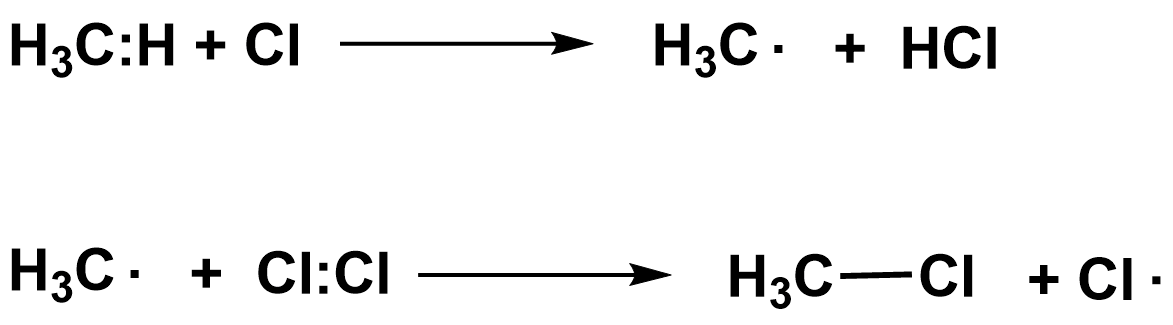
Обрыв цепи
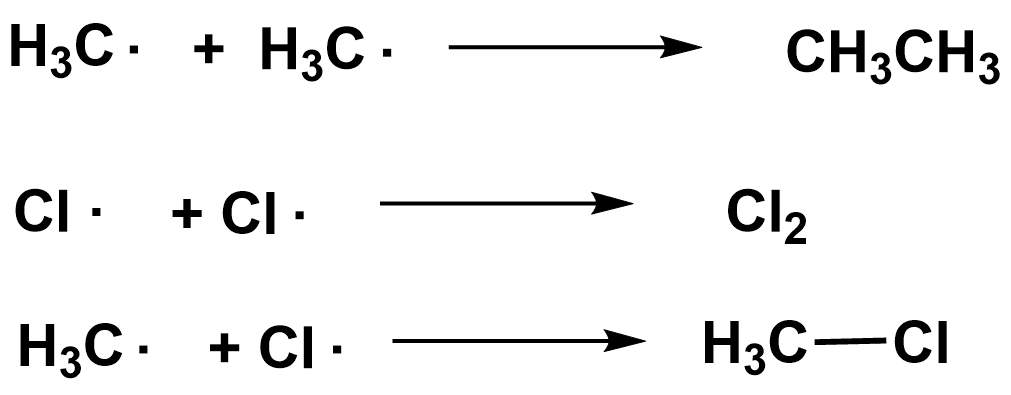
2. Свободно-радикальное присоединение
этен полиэтилен
Электрофильный механизм: реакцию начинают частицы-электрофилы, получающие положительный заряд в результате гетеролитического разрыва связи. Все электрофилы - кислоты Льюиса.
Такие частицы активно образуются под действием кислот Льюиса, которые усиливают положительный заряд частицы. Чаще других используются AlCl3,FeCl3,FeBr3,ZnCl2AlCl3,FeCl3,FeBr3,ZnCl2, выполняющие функции катализатора.
Местом атаки частицы-электрофила являются те участки молекулы, которые имеют повышенную электронную плотность, т. е. кратная связь и бензольное кольцо.
Общий вид реакций электрофильного замещения можно выразить уравнением:
1. Электрофильное замещение

бензол бромбензол
2. Электрофильное присоединение
пропен 2-бромпропан
пропин 1,2-дихлорпропен
Присоединение к несимметричным непредельным углеводородам происходит в соответствии с правилом Марковникова.
ОПРЕДЕЛЕНИЕ
Правило Марковникова: присоединение к несимметричным алкенам молекул сложных веществ с условной формулой НХ (где Х - это атом галогена или гидроксильная группа ОН–) атом водорода присоединяется к наиболее гидрогенизированному (содержащему больше всего атомов водорода) атому углерода при двойной связи, а Х - к наименее гидрогенизированному.
Например, присоединение хлороводорода HCl к молекуле пропена CH3–CH=CH2CH3–CH=CH2.
Реакция протекает по механизму электрофильного присоединения. За счет электронодонорного влияния CH3CH3-группы электронная плотность в молекуле субстрата смещена к центральному атому углерода (индуктивный эффект), а затем по системе двойных связей - к концевому атому углерода CH2CH2-группы (мезомерный эффект). Таким образом, избыточный отрицательный заряд локализован именно на этом атоме. Поэтому атаку начинает протон водорода H+H+, являющийся электрофильной частицей. Образуется положительно заряженный карбеновый ион [CH3–CH−CH3]++, к которому присоединяется анион хлора Cl−Cl−.
ОПРЕДЕЛЕНИЕ
Исключения из правила Марковникова: реакция присоединения протекает против правила Марковникова, если в реакцию вступают соединения, у которых атом углерода, соседний с атомом углерода двойной связи, оттягивает на себя частично электронную плотность, то есть при наличии заместителей, проявляющих значительный электроноакцепторный эффект (–CCl3,–CN,–COOH(–CCl3,–CN,–COOH и др.).
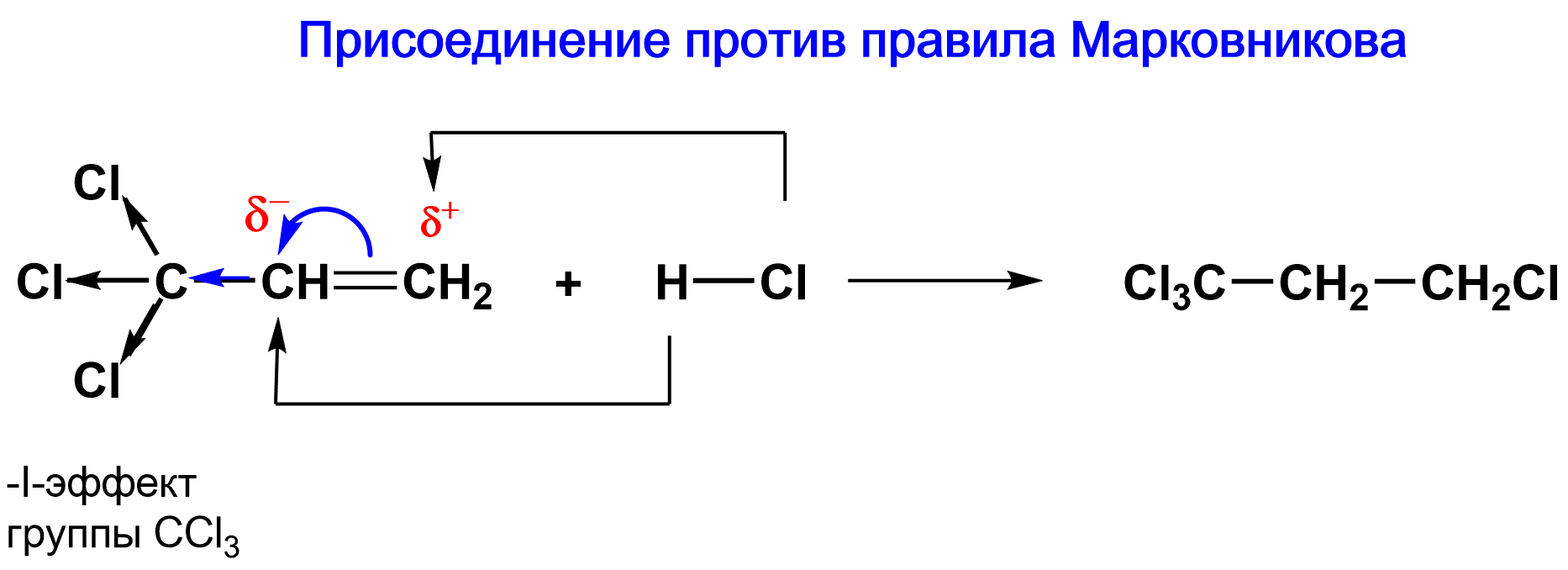
Нуклеофильный механизм: реакцию начинают частицы-нуклеофилы, имеющие отрицательный заряд, образовавшиеся в результате гетеролитического разрыва связи. Все нуклеофилы - основания Льюиса.
В нуклеофильных реакциях реагент (нуклеофил) имеет на одном из атомов свободную пару электронов и является нейтральной молекулой или анионом (Hal–,OH–,RO−,RS–,RCOO–,R–,CN–,H2O,ROH,NH3,RNH2Hal–,OH–,RO−,RS–,RCOO–,R–,CN–,H2O,ROH,NH3,RNH2 и др.).
Нуклеофил атакует в субстрате атом с наименьшей электронной плотностью (т. е. с частичным или полным положительным зарядом). Первой стадией реакции нуклеофильного замещения является ионизация субстрата с образованием карбкатиона. При этом новая связь образуется за счет электронной пары нуклеофила, а старая претерпевает гетеролитический разрыв с последующим отщеплением катиона. Примером нуклеофильной реакции может служить нуклеофильное замещение (символ SNSN) у насыщенного атома углерода, например щелочной гидролиз бромпроизводных.
1. Нуклеофильное замещение
2. Нуклеофильное присоединение
этаналь циангидрин
источник http://foxford.ru/wiki/himiya
В ходе реакции в молекулах реагирующих веществ разрываются одни химические связи и образуются другие. Органические реакции классифицируются по типу разрыва химических связей в реагирующих частицах. Из их числа можно выделить две большие группы реакций - радикальные и ионные.
Радикальные реакции - это процессы, идущие с гомолитическим разрывом ковалентной связи. При гомолитическом разрыве пара электронов, образующая связь, делится таким образом, что каждая из образующихся частиц получает по одному электрону. В результате гомолитического разрыва образуются свободные радикалы:
Нейтральный атом или частица с неспаренным электроном называется свободным радикалом.
Ионные реакции - это процессы, идущие с гетеролитическим разрывом ковалентных связей, когда оба электрона связи остаются с одной из ранее связанных частиц:
В результате гетеролитического разрыва связи получаются заряженные частицы: нуклеофильная и электрофильная.
Нуклеофильная частица (нуклеофил) - это частица, имеющая пару электронов на внешнем электронном уровне. За счет пары электронов нуклеофил способен образовывать новую ковалентную связь.
Электрофильная частица (электрофил) - это частица, имеющая незаполненный внешний электронный уровень. Электрофил представляет незаполненные, вакантные орбитали для образования ковалентной связи за счет электронов той частицы, с которой он взаимодействует.
В органической химии все структурные изменения рассматриваются относительно атома (или атомов) углерода, участвующего в реакции.
В соответствии с вышеизложенным хлорирование метана под действием света классифицируют как радикальное замещение, присоединение галогенов к алкенам - как электрофильное присоединение, а гидролиз алкилгалогенидов - как нуклеофильное замещение.
Наиболее часто встречаются следующие типы оеакций.
Основные типы химических реакций
I. Реакции замещения (замена одного или нескольких атомов водорода на атомы галогенов или спецгруппу) RCH 2 X + Y → RCH 2 Y + X
II. Реакции присоединения RCH=CH 2 + XY → RCHX−CH 2 Y
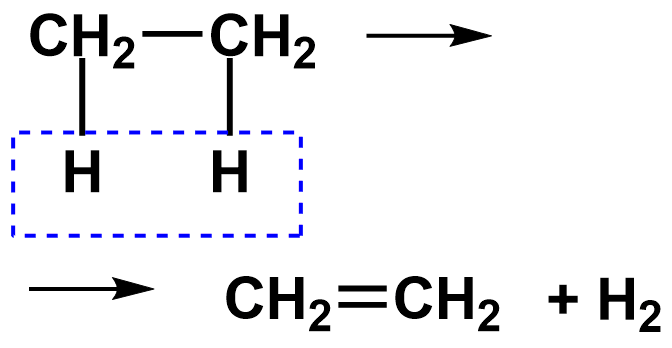
III. Реакции отщепления (элиминирования) RCHX−CH 2 Y → RCH=CH 2 + XY
IV. Реакции изомеризации (перегруппировки)
V. Реакции окисления (взаимодействие с кислородом воздуха или окислителя)
В этих вышеперечисленных типах реакции различают ещё и специализированные и именные реакции.
Специализированные:
1) гидрирование (взаимодействие с водородом)
2) дегидрирование (отщепление от молекулы водорода)
3) галогенирование (взаимодействие с галогеном: F 2 , Cl 2 , Br 2 , I 2)
4) дегалогенирование (отщепление от молекулы галогена)
5) гидрогалогенирование (взаимодействие с галогенводородом)
6) дегидрогалогенирование (отщепление от молекулы галогенводорода)
7) гидратация (взаимодействие с водой в необратимой реакции)
8) дегидратация (отщепление от молекулы воды)
9) гидролиз (взаимодействие с водой в обратимой реакции)
10) полимеризация (получение многократного увеличенного углеродного скелета из одинаковых простых соединений)
11) поликонденсация (получение многократного увеличенного углеродного скелета из двух разных соединений)
12) сульфирование (взаимодействие с серной кислотой)
13) нитрование (взаимодействие с азотной кислотой)
14) крекинг (уменьшение углеродного скелета)
15) пиролиз (разложение сложных органических веществ на более простые под действием высоких температур)
16) реакция алкилирования (введение в формулу радикала алкана)
17) реакция ацилирования (введение в формулу группы –C(CH 3)O)
18) реакция ароматизации (образование углеводорода ряда аренов)
19) реакция декарбоксилирования (отщепление от молекулы карбоксильной группы -COOH)
20) реакция этерификации (взаимодействие спирта с кислотой, или получение сложного эфира из спирта или карбоновой кислоты)
21) реакция «серебряного зеркала» (взаимодействие с аммиачным раствором оксида серебра (I))
Именные реакции:
1) реакция Вюрца (удлинение углеродного скелета при взаимодействии галогенпроизводного углеводорода с активным металлом)
2) реакция Кучерова (получение альдегида при взаимодействии ацетилена с водой)
3) реакция Коновалова (взаимодействие алкана с разбавленной азотной кислотой)
4) реакция Вагнера (окисление углеводородов с двойной связью кислородом окислителя в слабощелочной или нейтральной среде при нормальных условиях)
5) реакция Лебедева (дегидрирование и дегидратация спиртов при получении алкадиенов)
6) реакция Фриделя-Крафтса (реакция алкилирования арена хлоралканом при получении гомологов бензола)
7) реакция Зелинского (получение бензола из циклогексана дегидрированием)
8) реакция Кирхгофа (превращение крахмала в глюкозу при каталитическом действии серной кислоты)
Лекция:Классификация химических реакций в неорганической и органической химии
Виды химических реакций в неорганической химии
А) Классификация по количеству начальных веществ:
Разложение – вследствие данной реакции, из одного имеющегося сложного вещества, образуются два или несколько простых, а так же сложных веществ.
Пример:2Н 2 O 2 → 2Н 2 O + O 2
Соединение– это такая реакция, при которой из двух и более простых, а также сложных веществ, образуется одно, но более сложное.
Пример:4Al+3O 2 → 2Al 2 O 3
Замещение– это определенная химическая реакция, которая проходит между некоторыми простыми, а так же сложными веществами.Атомы простого вещества, в данной реакции, замещаются на атомы одного из элементов, находящегося в сложном веществе.
Пример:2КI + Cl2 → 2КCl + I 2
Обмен– это такая реакция, при которой два сложных по строению вещества обмениваются своими частями.
Пример:HCl + KNO 2 → KCl + HNO 2
Б) Классификация по тепловому эффекту:
Экзотермические реакции – это определенные химические реакции, при которых происходит выделение тепла.
Примеры:
S +O 2 → SO 2 + Q
2C 2 H 6 + 7O 2 → 4CO 2 +6H 2 O + Q
Эндотермические реакции– это определенные химические реакции, при которых происходит поглощение тепла. Как правило, это реакции разложения.
Примеры:
CaCO 3 → CaO + CO 2 – Q
2KClO 3 → 2KCl + 3O 2 – Q
Теплота, которая выделяется или поглощается в результате химической реакции, называется тепловым эффектом.
Химические уравнения, в которых указан тепловой эффект реакции, называют термохимическими.
В) Классификация по обратимости:
Обратимые реакции – это реакции, которые протекают при одинаковых условиях во взаимопротивоположных направлениях.
Пример:3H 2 + N 2 ⇌ 2NH 3
Необратимые реакции– это реакции, которые протекают только в одном направлении, а так же завершающиеся полным расходом всех исходных веществ. При этих реакциях выделяется газ, осадок, вода.
Пример:2KClO 3 → 2KCl + 3O 2
Г) Классификация по изменению степени окисления:
Окислительно - восстановительные реакции– в процессе данных реакций происходит изменение степени окисления.
Пример:Сu + 4HNO 3 → Cu(NO 3) 2 + 2NO 2 + 2H 2 O.
Не окислительно - восстановительные– реакции без изменения степени окисления.
Пример:HNO 3 + KOH → KNO 3 + H 2 O.
Д) Классификация по фазе:
Гомогенные реакции –реакции, протекающие в одной фазе, когда исходные вещества и продукты реакции имеют одно агрегатное состояние.
Пример:Н 2 (газ) + Cl 2 (газ) → 2HCL
Гетерогенные реакции– реакции, протекающие на поверхности раздела фаз, при которых продукты реакции и исходные вещества имеют разное агрегатное состояние.
Пример:CuO+ H 2 → Cu+H 2 O
Классификация по использованию катализатора:
Катализатор – вещество, которое ускоряет реакцию. Каталитическая реакция протекает в присутствии катализатора, некаталитическая – без катализатора.
Пример:2H 2 0 2 MnO 2→ 2H 2 O + O 2 катализатор MnO 2
Взаимодействие щелочи с кислотой протекает без катализатора.
Пример:КOH + HCl → КCl + H 2 O
Ингибиторы – вещества, замедляющие реакцию.
Катализаторы и ингибиторы сами в ходе реакции не расходуются.
Виды химических реакций в органической химии
Замещение – это реакция, в процессе которой происходит замена одного атома/группы атомов, в исходной молекуле, на иные атомы/группы атомов.
Пример:СН 4 + Сl 2 → СН 3 Сl + НСl
Присоединение– это реакции, при которых несколько молекул вещества соединяются в одну.К реакциям присоединения относятся:
- Гидрирование– реакция, в процессе которой происходит присоединение водорода по кратной связи.
Пример:СН 3 -СН = СН 2 (пропен) + Н 2 → СН 3 -СН 2 -СН 3 (пропан)
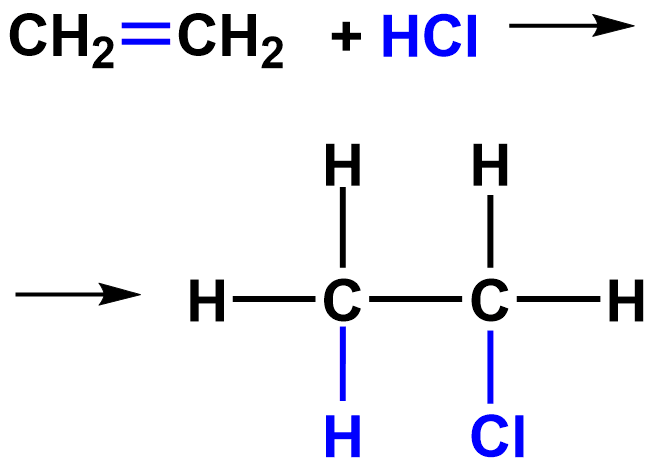
Гидрогалогенирование– реакция, присоединяющая галогенводород.
Пример:СН 2 = СН 2 (этен) + НСl → СН 3 -СН 2 -Сl (хлорэтан)
Алкины реагируют с галогеноводородами (хлороводородом, бромоводородом) так же, как и алкены. Присоединение в химической реакции проходит в 2 стадии, и определяется правилом Марковникова:
При присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода.
Механизм данной химической реакции.Образующийся в 1 - ой, быстрой стадии, p- комплекс во 2 - ой медленной стадии постепенно превращается в s-комплекс - карбокатион. В 3 - ей стадии происходит стабилизация карбокатиона – то есть взаимодействие с анионом брома:
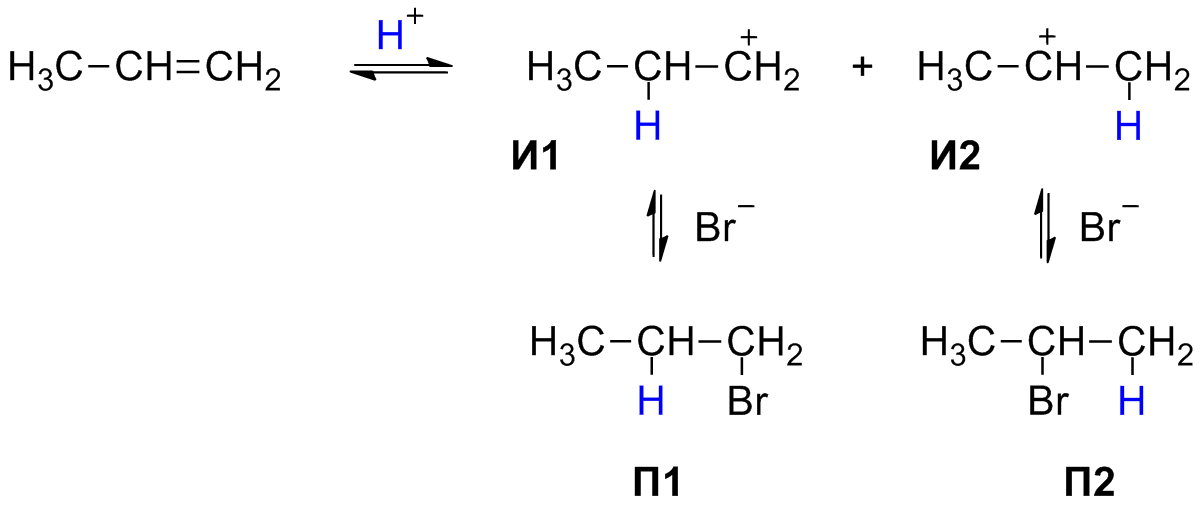
И1, И2 - карбокатионы. П1, П2 - бромиды.
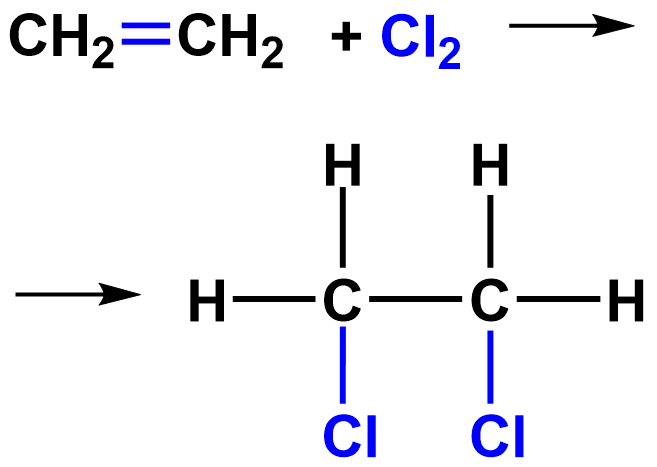
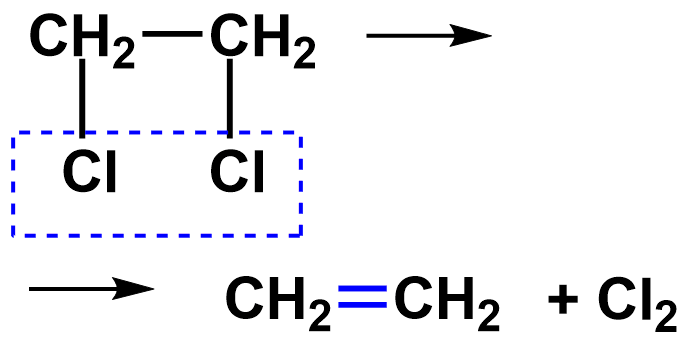
Галогенирование– реакция, при которой присоединяется галоген.Галогенированием так же, называют все процессы, в результате которых в органические соединения вводятся атомы галогена. Данное понятие употребляется в широком смысле. В соответствии с данным понятием, различают следующие химические реакции на основе галогенирования: фторирование, хлорирование, бромирование, йодирование.
Галогенсодержащие органические производные считаются важнейшими соединениями, которые применяются как в органическом синтезе, так и в качестве целевых продуктов. Галогенпроизводные углеводородов, считаются исходными продуктами в большом количестве реакций нуклеофильного замещения. Что касается практического использования соединений, содержащих галоген, то они применяются в виде растворителей, например хлорсодержащие соединения, холодильных агентов - хлорфторпроизводные, фреоны, пестицидов, фармацевтических препаратов, пластификаторов, мономеров для получения пластмасс.
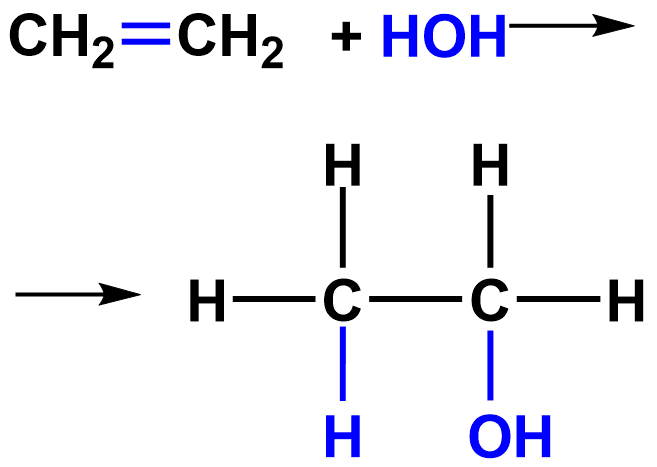
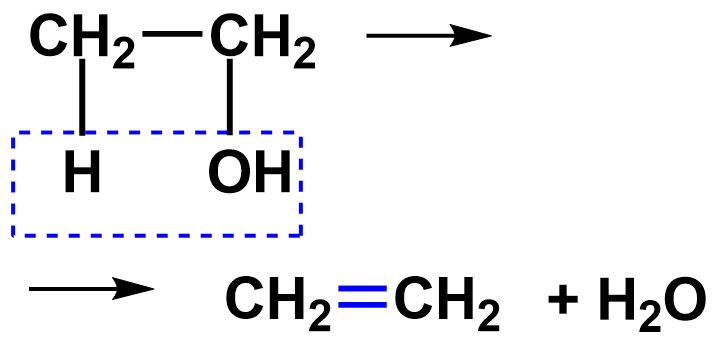
Гидратация– реакции присоединения молекулы воды по кратной связи.
Полимеризация – это особый вид реакции, при которой молекулы вещества, имеющие относительную невеликую молекулярную массу, присоединяются друг к другу, впоследствии образовывая молекулы вещества с высокой молекулярной массой.
Классификацияхимических реакций
Реферат похимии ученика 11 класса средней шк.№ 653 Николаева Алексея
В качестве классификационных признаков могут бытьвыбраны следующие:
1. Число и состав исходных веществ и продуктов реакции.
2. Агрегатное состояние реагентов и продуктов реакции.
3.Число фаз, в которых находятся участники реакции.
4. Природа переносимых частиц.
5. Возможность протекания реакции в прямом и обратномнаправлении.
6. Тепловой эффект.
7. Явление катализа.
Классификацияпо числу и составу исходных веществ и продуктов реакции.
Реакциисоединения.
При реакциях соединения изнескольких реагирующих веществ относительно простого состава получается одновещество более сложного состава:
A + B + C = D
Как правило, эти реакциисопровождаются выделением тепла, т.е. приводят к образованию более устойчивых именее богатых энергией соединений.
Неорганическаяхимия.
Реакции соединения простыхвеществ всегда носят окислительно-восстановительный характер. Реакциисоединения, протекающие между сложными веществами, могут происходить как безизменения валентности:
СаСО 3 + СО 2+ Н 2 О = Са(НСО 3) 2 ,
так и относиться к числуокислительно-восстановительных:
2FеСl 2 + Сl 2= 2FеСl 3 .
Органическаяхимия.
В органической химии такиереакции часто называют реакциями присоединения. В них обычно участвуютсоединения, содержащие двойную или тройную связь. Разновидности реакцийприсоединения: гидрирование, гидратация, гидрогалогенирование, полимеризация.Примеры данных реакций:
T o
Н 2 С = СН 2+ Н 2 → CН 3 – СН 3
этилен этан
T o
HC=CH + HCl → H 2 C=CHCl
ацетилен хлорвинил
T o
n СН 2 =СН 2 →(-СН 2 -СН 2 -)n
Этилен полиэтилен
Реакцииразложения.
Реакции разложения приводят кобразованию нескольких соединений из одного сложного вещества:
А = В + С + D.
Продуктами разложения сложноговещества могут быть как простые, так и сложные вещества.
Неорганическаяхимия.
Из реакций разложения,протекающих без изменения валентных состояний, следует отметить разложениекристаллогидратов, оснований, кислот и солей кислородсодержащих кислот:
| t o | ||
| CuSO 4 5H 2 O | CuSO 4 + 5H 2 O |
| t o | ||
| 4HNO 3 | 2H 2 O + 4NO 2 O+ O 2 O. |
2AgNO 3 = 2Ag + 2NO 2 + O 2 ,
(NH 4)2Cr 2 O 7 = Cr 2 O 3+ N 2 + 4H 2 O.
Органическаяхимия.
В органической химии к реакциямразложения относятся: дегидратация, дегидрирование» крекинг,дегидрогалогенирование, а также реакции деполимеризации, когда из полимераобразуется исходный мономер. Соответствующие уравнения реакций:
T o
С 2 Н 5 ОН→ C 2 H 4 + Н 2 O
T o
С 6 Н 14→ С 6 Н 6 + 4Н 2
гексан бензол
C 8 H 18→ C 4 H 10 + C 4 H 8
Октан бутан бутен
C 2 H5Br → C 2 H 4 +НВг
бромэтан этилен
(-СН 2 – СН = С - СН 2-)n → n СН 2 = СН – С =СН 2
\СНз \ СНз
природный каучук 2-метилбутадиен-1,3
Реакциизамещения.
При реакциях замещения обычнопростое вещество взаимодействует со сложным, образуя другое простое вещество идругое сложное:
А + ВС = АВ + С.
Неорганическаяхимия.
Эти реакции в подавляющембольшинстве принадлежат к окислительно-восстановительным:
2Аl + Fe 2 O 3= 2Fе + Аl 2 О 3
Zn + 2НСl = ZnСl 2 + Н 2
2КВr + Сl 2 = 2КСl +Вr 2
2КСlO 3 + l 2 =2KlO 3 +Сl 2 .
Примеры реакций замещения, несопровождающихся изменением валентных состояний атомов, крайне немногочисленны.Следует отметить реакцию двуокиси кремния с солями кислородсодержащих кислот,которым отвечают газообразные или летучие ангидриды:
СаСО 3 + SiO 2= СаSiO 3 + СО 2
Са 3 (РО 4) 2+ ЗSiO 2 = ЗСаSiO 3 + Р 2 О 5
Органическаяхимия.
В органической химии реакциизамещения понимаются шире, то есть замещать может не один атом, а группа атомовили замещается не атом, а группа атомов. К разновидности реакции замещенияможно отнести нитрование и галогенирование предельных углеводородов, ароматическихсоединений и спиртов:
C 6 H 6 + Br 2→ C 6 H 5 Br + HBr
бензол бромбензол
C 2 H 5 OH +HCl → C 2 H 5 Cl + H 2 O
Этанол хлорэтан
Реакцииобмена.
Реакциями обмена называют реакции между двумя соединениями, которыеобмениваются между собой своими составными частями:
АВ + СD = АD + СВ.
Неорганическаяхимия
Если при реакциях замещенияпротекают окислительно-восстановительные процессы, то реакции обмена всегдапроисходят без изменения валентного состояния атомов. Это наиболеераспространенная группа реакций между сложными веществами - оксидами,основаниями, кислотами и солями:
ZnO + Н 2 SО 4= ZnSО 4 + Н 2 О
AgNО 3 + КВr = АgВr +КNО 3
СrСl 3 + ЗNаОН =Сr(ОН) 3 + ЗNаСl.
Частный случай этих реакцийобмена - реакции нейтрализации:
НСl + КОН = КСl + Н 2 О.
Обычно эти реакции подчиняютсязаконам химического равновесия и протекают в том направлении, где хотя бы одноиз веществ удаляется из сферы реакции в виде газообразного, летучего вещества,осадка или малодиссоциирующего (для растворов) соединения:
NаНСО 3 + НСl = NаСl +Н 2 О + СО 2
Са(НСО 3) 2+ Са(ОН) 2 = 2СаСО 3 ↓ + 2Н 2 О
Органическаяхимия
НСООН + NaOH → HCOONa + Н 2 O
муравьиная кислота формиатнатрия
реакции гидролиза:
Na 2 CO3 + Н 2 О
NaHCO 3 + NaOH
карбонат натрия гидрокарбонатнатрия
СО 3 + Н 2 О
НСО 3 + ОН
реакции этерификации:
CH 3 COOH + C 2 H 5 OH
CH 3 COOC 2 H 5 +H 2 O
уксусная этанол этиловый эфир уксусной кислоты
Агрегатноесостояние реагентов и продуктов реакции.
Газовыереакции
| t o | ||
| H 2 + Cl 2 | 2HCl. |
Реакциив растворах
NaОН(рр) + НСl(p-p) = NaСl(p-p)+ Н 2 О(ж)
Реакциимежду твердыми веществами
| t o | ||
| СаО(тв) +SiO 2 (тв) | СаSiO 3 (тв) |
Число фаз, вкоторых находятся участники реакции.
Под фазой понимают совокупность однородных частейсистемы с одинаковыми физическими и химическими свойствами и отделенных друг отдруга поверхностью раздела.
Гомогенные(однофазные) реакции.
К ним относят реакции,протекающие в газовой фазе, и целый ряд реакций, протекающих в растворах.
Гетерогенные(многофазные) реакции.
К ним относят реакции, в которыхреагенты и продукты реакции находятся в разных фазах. Например:
газожидкофазные реакции
CO 2 (г) + NaOH(p-p) =NaHCO 3 (p-p).
газотвердофазные реакции
СO 2 (г) + СаО(тв) =СаСO 3 (тв).
жидкотвердофазные реакции
Na 2 SO 4 (рр)+ ВаСl 3 (рр) = ВаSО 4 (тв)↓ + 2NaСl(p-p).
жидкогазотвердофазные реакции
Са(НСО 3) 2 (рр)+ Н 2 SО 4 (рр) = СО 2 (r) +Н 2 О(ж)+ СаSО 4 (тв)↓.
Природапереносимых частиц.
Протолитическиереакции.
К протолитическим реакциям относят химическиепроцессы, суть которых заключается в переносе протона от одних реагирующихвеществ к другим.
В основе этой классификациилежит протолитическая теория кислот и оснований, в соответствии с которойкислотой считают любое вещество, отдающее протон, а основанием - вещество,способное присоединять протон, например:
К протолитическим реакциямотносят реакции нейтрализации и гидролиза.
Окислительно-восстановительныереакции.
Все химические реакцииподразделяются на такие, в которых степени окисления не изменяются (например,реакция обмена) и на такие, в которых происходит изменение степеней окисления.Их называют окислительно-восстановительными реакциями. Ими могут быть реакцииразложения, соединения, замещения и другие более сложные реакции. Например:
Zn+ 2H+→Zn2++H2
FeS 2 + 8HNO 3 (конц) = Fe(NO 3) 3+ 5NO + 2H 2 SO 4 + 2H 2 O
Подавляющее большинствохимических реакций относятся к окислительно-восстановительным, они играютисключительно важную роль.
Лиганднообменныереакции.
К таковым относят реакции, входе которых происходит перенос электронной пары с образованием ковалентнойсвязи по донорноакцепторному механизму. Например:
Cu(NO 3) 2 + 4NH 3 = (NO 3) 2
Fe + 5CO =
Al(OH) 3 + NaOH =
Характерной особенностьюлиганднообменных реакций является то, что образование новых соединений,называемых комплексными, происходит без изменения степени окисления.
Возможностьпротекания реакции в прямом и обратном направлении.
Необратимыереакции.
Необратимыми называют такие химические процессы, продукты которых неспособны реагировать друг с другом с образованием исходных веществ. Примераминеобратимых реакций может служить разложение бертолетовой соли при нагревании:
2КСlО 3 → 2КСl +ЗО 2 ,
или окисление глюкозы кислородомвоздуха:
С 6 Н 12 О 6+ 6О 2 → 6СО 2 + 6Н 2 О
Обратимыереакции.
Обратимыми называют такие химические процессы, продукты которыхспособны реагировать друг с другом в тех же условиях, в которых они получены, собразованием исходных веществ.
Для обратимых реакций уравнениепринято записывать следующим образом:
А + В
АВ.
Две противоположно направленныестрелки указывают на то, что при одних и тех же условиях одновременно протекаеткак прямая, так и обратная реакция, например:
СН 3 СООН + С 2 Н 5 ОН
СН 3 СООС 2 Н 5+ Н 2 О.
2SO 2 +O 2
2SO 3 + Q
Следовательно, данные реакции неидут до конца, потому, что одновременно происходят две реакции - прямая (междуисходными веществами) и обратная (разложение продукта реакции).
Классификацияпо тепловому эффекту.
Количество теплоты, котороевыделяется или поглощается в результате реакции, называется тепловым эффектомданной реакции. По тепловому эффекту реакции делят:
Экзотермические.
Протекают с выделением тепла
СН 4 + 2O 2→ СО 2 + 2Н 2 O + Q
Н 2 + Cl 2→ 2HCl+ Q
Эндотермические.
Протекают с поглощением тепла
N 2 +О2→ 2NO-Q
2Н 2 O → 2Н 2+ O 2 - Q
Классификацияс учетом явления катализа.
Каталитические.
К ним относятся все процессы сучастием катализаторов.
Кат.
2SO 2 + O 2
2SO 3
Некаталитические.
К ним относятся любые мгновеннопротекающие реакции в растворах
BaCl 2 + H 2 SO 4 = 2HCl + BaSO 4 ↓
Списоклитературы
Ресурсы Интернет:
http://chem.km.ru– «Мир Химии»
http://chemi.org.ru– «Пособие дляабитуриентов. Химия»
http://hemi.wallst.ru– «Альтернативный учебник по химии для 8-11 классов»
«Руководство по химии. Поступающим в ВУЗы» - Э.Т. Оганесян, М.1991г.
Большой ЭнциклопедическийСловарь. Химия» - М. 1998г.
>> Химия: Типы химических реакций в органической химии
Реакции органических веществ можно формально разделить на четыре основных типа: замещения, присоединения, отщепления (элиминирования) и перегруппировки (изомеризации). Очевидно, что все многообразие реакций органических соединений невозможно свести в рамки предложенной классификации (например, реакции горения). Однако такая классификация поможет установить аналогии с уже знакомыми вам из курса неорганической химии классификациями реакций, протекающих между неорганическими веществами.
Как правило, основное органическое соединение, участвующее в реакции, называют субстратом, а другой компонент реакции условно рассматривают как реагент.
Реакции замещения
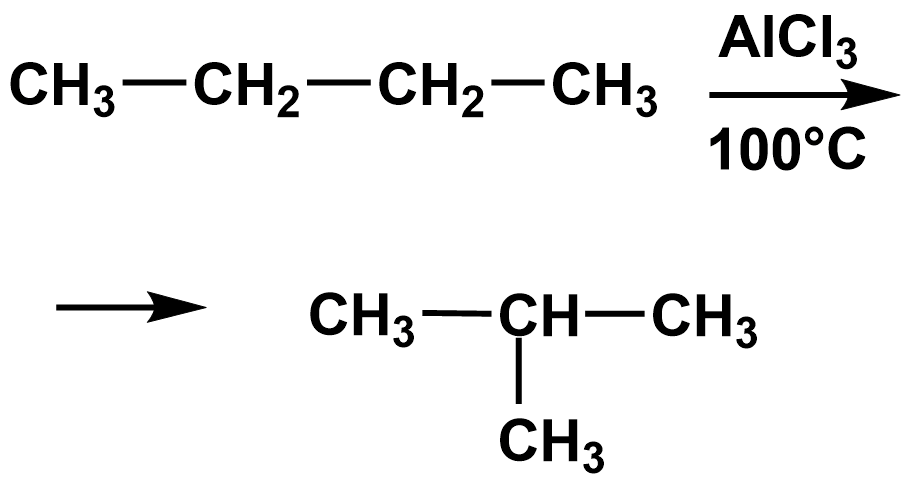
Реакции, в результате которых осуществляется замена одного атома или группы атомов в исходной молекуле (субстрате) на другие атомы или группы атомов, называются реакциями замещения.
В реакции замещения вступают предельные и ароматические соединения, такие, как, например, алканы, циклоалканы или арены.








Добавить комментарий